СТВОЛОВЫЕ КЛЕТКИ
Задайте ваш вопрос врачу в режиме "online", свяжитесь с намиКлеточная трансплантология. Методика лечения стволовыми клетками и фибробластами - Методика лечения стволовыми клетками Клеточная трансплантология. Информация о проведении лечения с помощью методов клеточной терапии - Методы клеточной терапии Клеточная трансплантология. Клеточная терапия. Стволовые клетки. Фибробласты. Применение стволовых клеток - Стволовые клетки Клеточная трансплантология.Ревитализация ( Омоложение ) - Омоложение Медицинская косметология и эстетическая медицина - Медицинская косметология
Клеточная терапия обширных поверхностных и глубоких ожоговых ран в настоящее время стала частью комплексного лечения ожоговых больных (1, 2, 3). Для
трансплантации на ожоговую поверхность обычно
использовали либо различные клетки: культивированные
аллофибробласты взрослого человека (6, 8, 9), либо ауто и аллогенные
кератиноциты без или в составе биоинженерных
конструкций (7, 15, 16). Анализ
результатов трансплантации этих клеток показал,
что использование кератиноцитов, а также
фибробластов является, хотя и эффективным, но
достаточно дорогостоящим методом лечения, что
ограничивает возможности его широкого
применения в клинической практике. Кроме того,
быстрый переход фибробластов при контакте с
коллагеном в фиброциты, которые обладают менее
выраженными ростстимулирующими и
пролиферативными свойствами, вынудило
клиницистов признать, что более эффективным
является использование культивированных
фетальных фибробластов, так как фетальные клетки
обеспечивали более
быструю регенерацию
и
реконвалесценцию больных (4, 5), чем аналогичные
клетки взрослого человека. Между тем существование нерешенных этических, правовых и юридических проблем, а также отсутствие законодательства, разрешающего забор и использование фетальных клеток заставило исследователей искать другие не менее эффективные, но более доступные источники клеток для заживления обширных, поверхностных и глубоких ожоговых ран кожи. В последние годы во всем мире получили развитие работы по использованию стволовых клеток костного мозга взрослого человека для восстановительного лечения поврежденных органов и тканей. В настоящее время доказано, что стволовые клетки костного мозга и прежде всего, стромальные клетки костного мозга при создании определенных условий для культивирования способны не только размножаться, но и предифференцироваться в клетки других тканей, в том числе и в фибробластоподобные клетки (13, 14, 17, 18, 19, 23, 24). Поскольку ауто и
аллогенные стромальные стволовые клетки
костного мозга при культивировании вырабатывают
компоненты матрикса, в том числе фибронектин,
ламенин, коллаген и протеогликаны (20, 21) и
способствуют неоангиогенезу (10,11,12) стало
очевидным, что эти клетки могут служить
адекватным биологическим субстратом для решения
одной из основных задач эстетической медицины -
восстановление естественного внешнего вида
термически поврежденных участков кожи. Целью настоящей работы явился анализ первого опыта использования в клинике аллогенных фибробластоподобных стволовых клеток костного мозга (ФМСК), для создания условий стимуляции восстановительных процессов и ускоренного заживления ожоговых ран после трансплантации их больному с 10% ожоговой поверхности кожи (IIIА степени повреждения). Заготовка аллогенного
клеточного материала для трансплантации. Забор клеток костного мозга для
получения мезенхимальных стволовых клеток (МСК)
и затем из них ФМСК проводили у взрослых людей
доноров под местной анестезией. Клетки получали
из подвздошной кости с использованием иглы
Кассирского. Доноры и их костный мозг были
проверены на отсутствие заражения вирусом
гепатита В, С, СПИДом, сифилисом, хламидиозом и
другими опасными инфекциями. Клетки костного мозга для получения
МСК предварительно культивировали на чашках
Петри при 37° С в С02- инкубаторе, в атмосфере
с 5% С02 и с 95% влажностью в среде Iskov’s (Gibco, Grand Island), содержащей 10%
бычьей эмбриональной сыворотки (HyClone, USA). Среду
заменяли через каждые 3-4 суток. Для получения
монослоя МСК требовалось 14-17 суток. В дальнейшем
МСК сохраняли методом криоконсервации как
исходный материал для получения ФМСК. Для
получения ФМСК суспензию МСК размораживали и
затем вновь культивировали в течение 7 суток
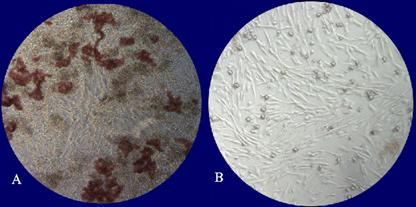
(Фото 1). Визуальный контроль культивируемых
клеток проводили ежедневно, с использованием
фазово-контрастной микроскопии (Nikon,
Япония). Из
прикрепившихся к поверхности пластика клеток
готовили суспензию ФМСК и наносили на
поверхность ожоговой раны с помощью пипетки, отходя от края раны
на Описание клинического
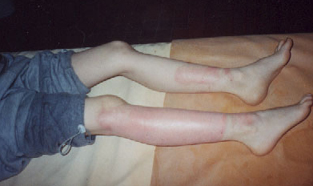
наблюдения. Больной Т., 8 лет, поступил в травматологическое отделение в ЦРБ г Оха Сахалинской области 1.06.03г. с диагнозом: Циркулярный термический ожог кожи паром II-IIIА степени нижней трети правого бедра, подколенной области, голени и передней поверхности левой голени площадью до 10% поверхности тела. Из анамнеза выяснено, что больной упал в яму теплоцентрали, где была горячая вода и получил термическую травму. В приемном отделении проведены противошоковые мероприятия и санация ожоговых ран, которая включала в себя также и удаление отслоенного эпидермиса из зон термического поражения. На следующий день повязка была обильно пропитана плазмой, нижние конечности в области икроножных мышц отекли, раны покрылись налетом фибрина. После ежедневной замены высыхающих повязок на влажные пропитанные фурациллином повязки к 6 суткам удалось очистить раны от фибринозного налета и уменьшить отечность конечностей. Однако истечение плазмы из ожоговых ран продолжалось. Визуально, отмечалось меленькие островки эпителизации ближе к краю ожоговых ран. В центральных участках процесс эпителизации отсутствовал или был подавлен развитием гнойной инфекции. Рана имела тенденцию к углублению (Фото 2). 8.06.03г. после тщательной санации зон термического повреждения на раны была нанесена суспензия ФМСК в количестве 30-40 х103 клеток на см2 ожоговой поверхности. Суспензия ФМСК была получена из криоконсервированных мезенхимальных стволовых клеток (МСК) ранее заготовленного костного мозга от взрослых людей- аллогенных доноров по технологии и по протоколу разработанным в институте в лаборатории биотехнологии стволовых клеток. Для получения ФМСК суспензию МСК размораживали и дополнительно культивировали в течении 7 суток, после чего клетки были готовы для трансплантации (Фото 2). После трансплантации ФМСК ожоговую поверхность покрывали стерильной марлевой салфеткой, смоченной физиологическим раствором с гентамицином. Было установлено, что уже через 20 минут после нанесения ФМСК на раневую поверхность ран покрылись блестящей тонкой пленкой, истечение плазмы прекратилось. На следующие сутки повязка оставалась чистой и не прилипала к ожоговым ранам, так как отсутствовала плазморрея. Имело место некоторое утолщение вновь образованной пленки. В последующие сутки рану вели традиционным способом с использованием мази левомеколь. Перевязки производили через 2-3 суток. Уже на 3 сутки после трансплантации ФМСК на ожоговой поверхности можно было увидеть новообразованную сеть сосудов. На 7-е сутки края первоначально образованной пленки в зонах повреждения приподнимались над окружающими здоровыми тканями и легко отделялись от подлежащих тканей. После удаления пленки хорошо просматривался тонкий эпидермальный слой клеток, который равномерно покрывал ожоговую поверхность (Фото 3). 16.06.03г. т.е. на 8 сутки после трансплантации аллогенных ФМСК, ожоговые раны полностью эпителизировались и больной был выписан домой. Таким образом, проведенная нами трансплантация аллогенных ФМСК позволила существенно ускорить и процесс заживления термических ожогов кожи и тем самым ускорить общий процесс реабилитации ожогового больного. Проведенное нами ранее изучение особенностей течения раневого процесса при моделировании ожогов на животных (10, 11, 12), а также результаты первого клинического опыта применения ФМСК для лечения обширных поверхностных ожогов кожи, описанных выше, позволяют нам заключить: 1. Пересадка аллогенных ФМСК на ожоговую рану является неинвазивным и безопасным методом лечения термических повреждений кожи IIIА степени.
2.
Метод способствует новообразованию
сосудов, в результате чего при ожоговых
поражениях
IIIА степени активизируется
эпителизация ран и снижается риск развития
рубцовых образований. НИИ трансплантологии и искусственных органов МЗ РФ, к.м.н. М.Ф.Расулов
Адрес: НИИ трансплантологии
и искусственных органов МЗ РФ Москва,
123182 ул. Щукинская, д.1. E.Mail:
stemcell@newmail.ru Подписи под рисунками к статье.
М.Ф.Расулова Опыт применения мезенхимальных
стволовых клеток костного мозга для лечения
больного с поверхностными ожоговыми ранами кожи.
Фото 1. Микрофотография предварительно культивированных ФМСК на пластике. Ув. х100. А) Образование клонов ФМСК (указано стрелкой) под гемопоэтическими стволовыми клетками костного мозга (7 сутки). В) Образование монослоя ФМСК (11 сутки). Фото 2. Истечение плазмы из участков циркулярного термического поражения III А степени нижних конечностей (перед трансплантацией ФМСК). Фото 3. Полная эпителизация ожоговой поверхности на 8 сутки после трансплантации ФМСК. Подписи к фото 1,2,3
Фото1
Фото2
Фото 3
Расулова М.Ф. и соавт. «Опыт применения мезенхимальных стволовых клеток костного мозга для лечения больного с поверхностными ожоговыми ранами кожи». 1. Колокольчикова Е.Г., Будкевич Л.И., Бобровников А.Э. и соавт. Морфологические изменения ожоговых ран после пересадки аллогенных фибробластов. // Бюлл. экспер. биол. 2001. Т. 131, № 1. С.107-111. 2. Матчин
Е. Н., Потапов В. П., Огольцова В. А., Кузько Ю. Н.
Клинико-гистологические результаты кожной
аутопластики традиционными методами и с
использованием клеточной культуры фибробластов
// В кн.: Новые методы лечения ожогов с
использованием культивированных
аллофибробластов. II Меж. симпозиум. Саратов. 1998. С.25. 3. Парамонов Б.А., Смирнова Т.Д., Кухарева Л.В. и соавт. Совершенствование биотехнологических методов восстановления кожного покрова. В сб. "Комбустиология на рубеже веков" Мат. Конгресса. Москва, 2000, С. 164.
4. Расулов
М.Ф., Хаджибаев А.М., Уразметова М.Д. Применение
аллогенных фибробластов у больных при обширных
поверхностных термических повреждениях кожи. //
Мед. журн. Узбекистана 2001. №5-6. С. 87-88. 5. Саидгалин Г.З., Салистый П.В., Панова О.В., и соавт. Аллофибробласты в лечении глубоких ожогов у детей. // В сб. "Комбустиология на рубеже веков" Мат. Конгресса. Москва, 2000, С. 166. 6. Саркисов
Д.С., Алексеев А.А., Глущенко Е.В., и соавт. Теоретические и практические
аспекты использования культивированных
фибробластов при восстановлении целостности
кожных покровов. // Вестн.
РАМН. 1996. №6, С. 6-11. 7. Туманов
В. П., Пальцин А. А.,Саркисов Д. С. Пластика ожоговых
ран с помощью культивированного эпителия // Acta chir. Plast, 1989, Vol. 31, P. 14-20.
8.
Туманов
В.П., Глущенко Е.В., Морозов С.С., Саркисов Д.С.
Использование
культивированных фибробластов при лечении
ожоговых ран. // Бюлл. экспер. биол. 1990.Т
109,
№
4.С. 400-403.
9.
Фeдоров
В. Д., Саркисов Д. С., Алексеев А. А. и соавт.
Пластическое восстановление кожных покровов с
использованием культивированных
аллофибробластов. // Анналы хирургии, 1996, N 4, С. 16.
10.
Шумаков
В.И., Онищенко Н.А., Расулов М.Ф. и соавт.
Использование предифференцированных
мезенхимальных стволовых клеток костного мозга
для лечения глубоких ожоговых ран. // Вестн.
хирургии им И.И. Грекова 2003. Т 162, № 4. С.38-41. 11. Шумаков В.И., Онищенко Н.А., Расулов М.Ф. и соавт. Мезенхимальные стволовые клетки костного мозга эффективнее эмбриональных фибробластов стимулируют регенерацию глубоких ожоговых ран. // Бюл. экспер. биол. 2003. Т. 136, № 8. С.220-223.
12. Шумаков В.И.,
Расулов М.Ф., Крашенинников М.Е. и соавт.
Сравнительная оценка эффективности применения
аллогенных эмбриональных фибробластов и
мезенхимальных стволовых клеток костного мозга
для терапии глубоких ожоговых ран. //Вестн.
трансплантол. и искусствен. органов.2002. №4.
С.7-11. 13. Asahara T, Murohara T,
Sullivan A. Isolation of putative progenitor endothelial cells for angiogenesis. Science
1997; 275:964–7. 14. Boyan B.D., Caplan
A.I., Heckman J.D., Lennon D.P., Ehler W., Schwartz Z. “Osteochondral progenitor cells
in acute and chronic canine nonunions.” J. Orthop. Res. 17: 246-255, 1999. 15. De Lapp, Dieckman DK.
Effect of basic fibroblast growth factors type I (IGF-I) and type II (I&F) on adult
human keratinocyte growth and fibronectin secretion // J.Invest.Dermat, 1990, Vol.94, N.6,
P.817-822. 16. Dedovic Z, Koupilovia
I, Suchanek I. Keratinocytes as biological dressing in the treatment of partial-thickness
burns in children // Ann. Burns and Fire Disasters 1998 Vol 11 N 1 p.37-40. 17. Gronthos, S.,
Zannettino A.C., Graves S.E., Onta S., Hay S.I., Simmons P.I. “Differential cell surface
expression of the STRO-1 and alkaline phosphatase antigenes on discrete developmental
stages in primary cultures of human bone cells.” J. Bone Miner. Res. 14: 47-56, 1999. 18. Gruber
R, Mayer C, Schulz W et al. Stimulatory effects of cartilage-derived morphogenetic
proteins 1 and 2 on osteogenic differentiation of bone marrow stromal cells. // Cytokine
2000, V12, N11, P. 1630-1638. 19. Majumdar
MK, Banks V, Peluso DP et al. Isolation, characterization, and chondrogenic potential of
human bone marrow-derived multipotential stromal cells. // J Cell Physiol 2000, V185, N1,
P. 98-106. 20. Pittenger M. F.,
Mackay A. M., Beck S. C., Jaiswal R.K., Douglas R., Mosca J.D., Moorman M.A., Simonetti
D.W., Craig S., Marshak D.R. “Multilineage potential of adult human mesenchymal stem
cells.” Science. 284: 143-147, 1999. 21. Prockop, D.J.
“Marrow stromal cells as stem cells for non-hematopoietic tissues.” Science 276:
71-74, 1997. 22. Seshi
B, Kumar S, Sellers D. Human Bone Marrow Stromal Cell: Coexpression of Markers Specific
for Multiple Mesenchymal Cell Lineages // Blood Cells, Molecules, and Diseases 2000, V.26,
N.3, June, P. 234–246. 23. Williams
J.T., Southerland S.S., Souza J., Calcutt A.F., Cartledge R.G. “cells isolated from
adult human skeletal muscle capable of differentiating into multiple mesodermal
phenotypes.” Am. Surg. 65: 22-26, 1999. 24. Zuk P.A., Min Zhu,
Mizuno H., et al. “Multilineage cells from human adipose tissue: implications for
cell-based therapies.” Tissue Engineering, 2001, V7, N2, 211-228.
|



 вверх
вверх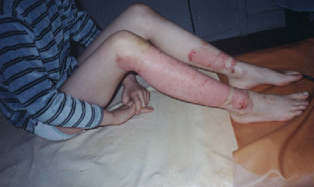
 вниз
вниз